進貨單( 0 )
建議零售價: ¥37.00/盒
亮健價:¥認證可見 / 盒
通用名稱: 依托考昔片
生產廠家: 杭州默沙東制藥有限公司
批準文號: 國藥準字J20180057
有效期:
是否拆零:是

格列齊特緩釋片
山東司邦得制藥有限公司
30mg*30片

吡諾克辛滴眼液
參天制藥(中國)有限公司
5ml

氧氟沙星眼膏
參天制藥(中國)有限公司 分裝
3.5g:10.5mg

地奈德乳膏
重慶華邦制藥有限公司
15g

卡泊三醇軟膏
重慶華邦制藥有限公司
15g(金迪銀)

鹽酸左西替利嗪口服溶液
重慶華邦制藥有限公司
0.05% 10ml*6支

鹽酸帕羅西汀腸溶緩釋片
BORA PHARMACEUTICAL SERVICES INC.
25mg*10片(賽樂特)

甲氨蝶呤片
上海上藥信誼藥廠有限公司
2.5mg*100片(信誼)

水飛薊賓膠囊
天津天士力圣特制藥有限公司
35mg*10粒*2板(水林佳)

西羅莫司片
Pfizer Ireland Pharmaceuticals
1mg*10片

多索茶堿片
福安藥業(yè)集團寧波天衡制藥有限公司
0.2g*24片

蚓激酶腸溶膠囊
珠海博康藥業(yè)有限公司
20萬單位*12粒(雪通)

鹽酸二甲雙胍緩釋膠囊
河北愛爾海泰制藥有限公司
0.25g*48粒

沙利度胺膠囊
蘇州長征-欣凱制藥有限公司
25mg*48粒(愛然)

奧美沙坦酯片
第一三共制藥(上海)有限公司
20mg*7片(傲坦)


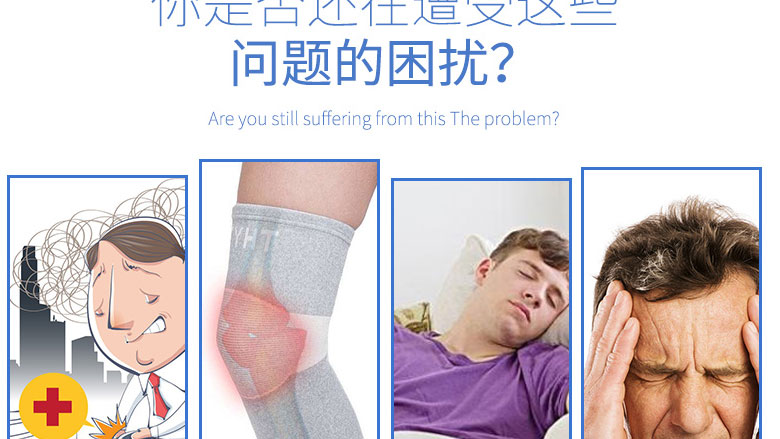





| 產品名稱 | 安康信 依托考昔片 60mg*5片 |
| 產品規(guī)格 | 60mg*5片 |
| 生產企業(yè) | 杭州默沙東制藥有限公司 |
| 批準文號 | 國藥準字J20180057 |
| 性狀 | 淺綠色、蘋果形雙面凸的薄膜衣片劑,一側刻有ARCOXIA 120,另一側刻有204。 |
| 有效日期 | 1095 |
| 主要原料 | 主要成份為依托考昔。 【成 份】 化學名:5-氟-6‘-甲基-3-[4-(甲磺酰基)苯基]-2,3’-聯吡啶 |
| 主要作用 | 用于治療急性痛風性關節(jié)炎。 |
| 用法用量 | 本品用于口服,可與食物同服或單獨服用。急性痛風性關節(jié)炎-推薦劑量為120毫克,每日1次。本品120毫克只適用于癥狀急性發(fā)作期,最長使用8天。使用劑量大于推薦劑量時,尚未證實有更好的療效或目前尚未研究。因此,上述劑量是最大推薦劑量。因為選擇性環(huán)氧化酶-2抑制劑的心血管危險性會隨劑量升高和用藥時間延長而增加,所以應盡可能減短用藥時間和使用每日最低有效劑量。應定期評估患者癥狀的緩解情況和患者對治療的反應。 |
| 禁忌 | 以下患者禁用安康信。 對其任何一種成份過敏; 充血性心衰(紐約心臟病學會[NYHA]心功能分級Ⅱ-Ⅳ); 確診的缺血性心臟病和/或腦血管病(包括近期進行過冠狀動脈搭橋術或血管成形術的患者)。 |
| 注意事項 | 臨床試驗提示相比于安慰劑和一些非甾體抗炎藥(萘普生),選擇性環(huán)氧化酶-2抑制劑發(fā)生血栓事件(尤其是心肌梗塞和中風)的危險性要高。因為選擇性環(huán)氧化酶-2抑制劑的心血管危險性可能會隨劑量升高和用藥時間延長而增加,所以應盡可能縮短用藥時間和使用每日最低有效劑量。應定期評估患者癥狀的緩解情況和患者對治療的反應。 伴有明顯的心血管事件危險因素(如高血壓、高血脂、糖尿病、吸煙)或末梢動脈病的患者必須慎重考慮之后才能使用安康信治療。 選擇性環(huán)氧化酶-2抑制劑不能替代阿司匹林用于心血管預防,因為它沒有抑制血小板聚集的作用。安康信是這一類藥物中的一種,不能抑制血小板凝集,所以不能停止抗血小板治療。 當依托考昔、其他選擇性環(huán)氧化酶-2抑制劑和非甾體抗炎藥與阿司匹林(即使是最低劑量)合用時,發(fā)生胃腸道不良事件(胃腸道潰瘍或其他胃腸道并發(fā)癥)的危險性增高。選擇性環(huán)氧化酶-2抑制劑與阿司匹林合用對比于非甾體抗炎藥與阿司匹林合用對胃腸道安全性影響的差異還未在長期臨床研究中評價過。 對晚期腎臟疾病患者,不推薦用安康信治療。肌酐清除率<30ml/min的患者應用安康信的臨床經驗非常有限。如必須用安康信開始治療這些患者,建議密切監(jiān)測患者的腎功能。 腎臟分泌的前列腺素可能對維持腎灌注起到代償作用。因此,在腎臟灌注受損時,使用安康信可導致前列腺素生成減少,繼而使腎血流量減少,從而損害了腎功能。對這種反應敏感的患者包括已患有明顯腎功能不全,失代償性心衰或肝硬化的患者。對這些患者應考慮監(jiān)測腎功能。與能抑制前列腺素合成的其它已知藥物一樣,停用安康信后,可望恢復到治療前狀態(tài)。 對明顯脫水的患者,應當謹慎使用安康信。建議在開始用安康信治療前進行補液。 與已知能抑制前列腺素合成的其他藥物一樣,一些患者服用安康信后可觀察到體液潴留、水腫和高血壓。對原有水腫、高血壓或心衰的患者使用安康信時應考慮到體液潴留、水腫或高血壓的可能性。安康信與一些非甾體抗炎藥和其他選擇性環(huán)氧化酶-2抑制劑相比,尤其在高劑量時,可能會更經常發(fā)生高血壓或發(fā)生較嚴重的高血壓,因此使用安康信治療時,要密切注意血壓監(jiān)測。如果血壓明顯升高,須考慮其他治療。 醫(yī)生應當注意到某些患者可能會發(fā)生與治療無關的上消化道(Gl)潰瘍/潰瘍并發(fā)癥。在臨床研究中,服用安康信120毫克每日1次的患者發(fā)生內窺鏡所能檢測到的上消化道潰瘍的危險性要比應用非選擇性非甾體抗炎藥的患者低,但比安慰劑組高。用安康信治療的患者中有上消化道潰瘍/潰瘍并發(fā)癥發(fā)生。既往有胃腸道穿孔、潰瘍和出血(PUB)史的患者以及年齡大于65歲的患者發(fā)生PUB的危險性較高,這與服用安康信治療無關。 在服用安康信每日60毫克和90毫克長達1年的臨床研究中,發(fā)現約1%的患者出現谷丙轉氨酶和/或谷草轉氨酶增高(約為正常上限的3倍或以上)。在藥物臨床對照的研究中,用安康信每日60和90毫克治療的患者中谷草轉氨酶和/或谷丙轉氨酶增高的發(fā)生率與用萘普生治療組的患者發(fā)生率相似,但要明顯低于雙氯芬酸組的發(fā)生率。在用安康信治療的患者中,谷草轉氨酶和/或谷丙轉氨酶增高都能恢復,其中大約半熟患者在繼續(xù)治療期間谷草轉氨酶和/或谷丙轉氨酶恢復正常。 對癥狀和/或體征提示肝功能異常,或經化驗證實肝功能異常的患者,應評估有無肝功能持續(xù)異常。如果肝功能持續(xù)異常(正常上限的3倍),應當停用安康信治療。 對既往曾因水楊酸鹽或非選擇性環(huán)氧化酶抑制劑而導致急性哮喘發(fā)作、蕁麻疹或鼻炎的患者,應慎用安康信。由于這些反應的病理生理機制尚不清楚,醫(yī)生應當權衡應用安康信的益處與潛在危險。 此外,安康信可掩蓋感染的體征-發(fā)熱。尤其給正在進行抗感染治療的患者應用安康信時應注意。 |
| 不良反應 | 據國外文獻報道 在臨床試驗中,對約4800例個體進行了安全性評價,包括約3400例骨關節(jié)炎、風濕性關節(jié)炎或慢性腰背痛的患者(約600例骨關節(jié)炎或風濕性關節(jié)炎患者治療達1年或更長時間)。 下列與藥物相關的不良事件是在對骨關節(jié)炎、風濕性關節(jié)炎或慢性腰背痛患者中進行的長達12周的數項臨床研究中報告的,在用安康信治療的患者中發(fā)生率≥1%,且高于安慰劑組:無力/疲乏、頭暈、下肢水腫、高血壓、消化不良、胃灼熱、惡心、頭痛、谷丙轉氨酶(ALT)增高和谷草轉氨酶(AST)增高等。 骨關節(jié)炎或風濕性關節(jié)炎患者使用安康信治療1年或更長時間,其不良事件的發(fā)生情況相類似。 在另一項對7111例骨關節(jié)炎患者的臨床研究中,比較了依托考昔90毫克(相當于治療骨關節(jié)炎劑量的1.5倍)每日1次和雙氯芬酸鈉50毫克每日3次用藥9個月的胃腸道耐受性。安康信的不良事件發(fā)生情況大致類似于Ⅱb或Ⅲ期安慰劑對照的臨床研究的報告;然而,安康信組高血壓不良事件發(fā)生率比雙氯芬酸組要高。 在一項強直脊椎炎的臨床研究中,患者接受安康信90毫克每日1次治療長達1年(入選患者數為126名)。此研究中的不良事件發(fā)生情況與骨關節(jié)炎、風濕性關節(jié)炎的長期研究和慢性腰背痛研究的結果類似。 在一項急性痛風性關節(jié)炎的臨床研究中,患者接受安康信120毫克每日1次治療8天,該研究不良事件發(fā)生情況與骨關節(jié)炎、風濕性關節(jié)炎和慢性腰背痛的研究報告類似。 在急性鎮(zhèn)痛臨床研究中,患者接受安康信120毫克每日1次治療1到7天,這些研究中的不良事件發(fā)生情況大致類似于骨關節(jié)炎、風濕性關節(jié)炎和慢性腰背痛研究的綜合報告。 上市后用藥經驗: 安康信上市后有下列不良反應的報道: 免疫系統(tǒng)異常:過敏反應,包括過敏性或過敏性樣反應; 精神異常:焦慮、失眠; 神經系統(tǒng)異常:味覺障礙,嗜睡; 心臟異常:充血性心衰; 血管異常:高血壓危象; 呼吸、胸部和縱隔異常:支氣管痙攣; 胃腸道異常:腹痛、口腔潰瘍、消化道潰瘍包括穿孔和出血(主要發(fā)生在老年患者),嘔吐、腹瀉。 肝膽異常:肝炎。 皮膚和皮下組織異常:血管性水腫,瘙癢,皮疹,Stevens-Johnson綜合癥,風疹。 腎臟和泌尿系統(tǒng)異常:腎功能不全,包括腎衰,一般在停藥后可恢復(見注意事項)。 |
| 貯藏 | 密閉,室溫保存。 |
廣東亮健藥業(yè)有限公司-國家藥監(jiān)局認證的合法網上藥店,致力于打造優(yōu)質、低價、便捷的網上藥店和最專業(yè)的健康服務平臺
版權所有 Copyright?2006-2019 www.360lj.com All rights reserved


 進貨單
進貨單
